
1.CRC(治験コーディネーター)とは
製薬会社が新薬を開発するとき、最終段階で人体への有効性と安全性を確認するために「臨床試験(=治験)」をおこないます。その治験の調整役となるのが、治験コーディネーターです。英語表記の「Clinical Research Coordinator」を略して、CRCと呼ばれます。
2.治験コーディネーターの仕事内容
2-1.治験に関わる人たち
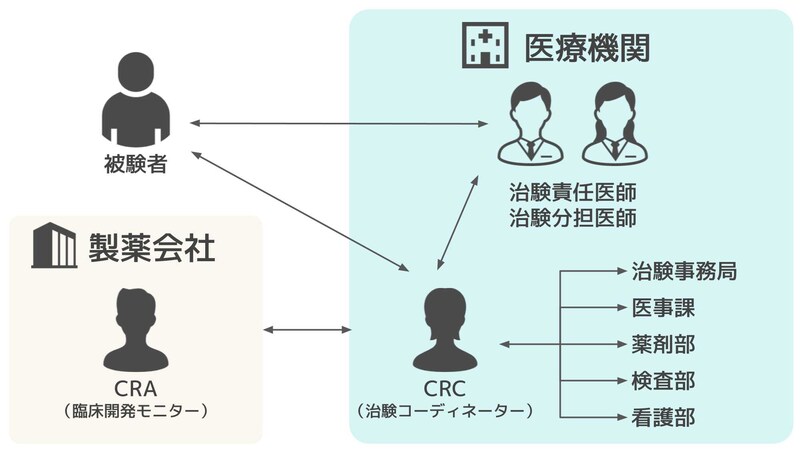
治験コーディネーターは、製薬会社の臨床開発モニター(CRA)や、治験を実施する医療機関の医師(治験責任医師、治験分担医師)、各部署(治験事務局、医事課、薬剤部、検査部、看護部)と協力して治験を進め、被験者となる患者さんをサポートします。
point
治験:くすりの候補の有効性と安全性を確かめる臨床試験
製薬会社:医療機関に治験の実施を依頼
臨床開発モニター:治験が適正に実施されているか確認(モニタリング)
医療機関:法律に基づいて治験を実施
治験責任医師:治験に関連する医療上のすべての判断に責任を負う
治験分担医師:治験責任医師の指導・監督のもと治験を実施
被験者:治験に参加する患者さん
治験コーディネーター:製薬会社、医療機関、被験者の間で調整をおこなう
2-2.治験の流れ・仕事内容
治験コーディネーターは主に医療機関で働きます。医療機関の治験事務局に直接雇用されるパターンと、民間企業であるSMO(治験施設支援機関)から医療機関に派遣されるパターンがありますが、仕事内容はほとんど変わりません。
治験は数ヶ月〜数年にわたるので、基本的に1つの治験を担当しますが、SMOから派遣される治験コーディネーターは、複数の医療機関で治験を担当することもあるようです。
治験コーディネーターの仕事を3つのステップに分けて解説します。
<1.治験準備時>
・治験実施計画書(プロトコル)の理解治験の実施において、製薬会社と医療機関は「薬機法(旧・薬事法)」と「医薬品の臨床試験の実施の基準に関する省令(Good Clinical Practice=GCP)」を遵守しなければなりません。
製薬会社がGCPに基づいて「治験実施計画書」を作成し、治験責任医師が計画書に合意することで、治験に向けた準備が始まります。
CRCは担当する「治験実施計画書」を読み込み、理解を深めなければなりません。製薬会社の臨床開発モニターから説明を受けたり、医師や看護師、薬剤師、臨床検査技師から情報を集めたりして、治験薬と対象の疾患について学びます。
・スタートアップミーティングの補助製薬会社の臨床開発モニターは、治験責任医師や治験分担医師、治験コーディネーター、看護師、臨床検査技師、薬剤師、治験事務局への説明・役割分担をおこなうスタートアップミーティングを開きます。その際、治験コーディネーターはミーティング用の資料作成や議事進行のサポートをします。
・検査機器の管理製薬会社から搬入される検査機器類や検査キットを適切に管理し、被験者が来院した際の準備を進めます。
<2.治験実施時>
・被験者募集(スクリーニング)被験者の募集と「治験実施計画書」の基準に合わせたスクリーニングをおこないます。候補者を探す方法には、医師からの紹介、病院のカルテや医療情報システムから探す方法、新聞やインターネット広告の利用(生活習慣病などが対象の場合)などがあります。
・治験の説明文書と同意書の作成治験責任医師が被験者に事前説明(インフォームド・コンセント)をおこなう場に同席します。医師からは治験内容、来院スケジュール、予想される副作用などについて説明がおこなわれます。治験コーディネーターは被験者に渡す治験の説明文書や同意書の作成をサポートします。
・被験者のスケジュール管理と対応被験者の来院日、検査・投薬予定日などを管理します。来院時には医師の診察に同席し、服薬状況の確認、有害事象のチェック、残薬回収、併用薬剤の確認、服薬指導、負担軽減費支払いの確認などをおこないます。
・症例報告書(CRF)の作成製薬会社に報告する「症例報告書(CRF)」を作成します。治験コーディネーターは、治験責任医師の指示に従い、原資料(カルテや投薬記録票、検査結果伝票、投影画像、症状についての所感記録など)から医学的判断を要しないデータを確認し、症例報告書に転記します。
・有害事象への対応治験中に被験者に副作用などの好ましくない有害な反応が起こった際(有害事象)の対応をおこないます。治験コーディネーターはただちに治験責任医師に報告し、被験者への適切な処置を促します。
その後、事象発生の経緯、関連する検査値や併用薬、治験薬との因果関係などをまとめた報告書を作成し、製薬会社および病院長に提出します。
<3.治験終了時>
・治験終了報告書の作成症例報告書(CRF)が製薬会社と契約した数に達し、被験者の最終観察・追跡調査などが終了したら、「治験終了報告書」の原案を作成します。
治験終了報告書には、治験ステータス(終了・中止・中断)、実施例数、目標とする被験者数、治験結果の概要(有効性・安全性・GCP遵守状況など)を記載。原案を治験責任医師が内容を確認したうえで、実施医療機関の院長に提出します。
予定より早く契約症例数に達した場合、製薬会社から追加の治験を依頼されることがあります。追加症例を集められると製薬会社からの評価が上がり、治験コーディネーターの査定にもつながります。


