
1.CRA(臨床開発モニター)とは
臨床開発モニターは医療機関へ治験の実施を依頼し、治験の実施が決定したあとは、全体の管理とモニタリングをおこないます。
英語では「Clinical Research Associate」と表記されるため、「CRA」と略されます。
point
治験→治験とは、病院などの臨床現場で被験者(患者)に対して開発中の新薬を投薬し、有効性と安全性を確認する新薬開発の最終段階における臨床試験のこと。
1-1.治験コーディネーター(CRC)との違い
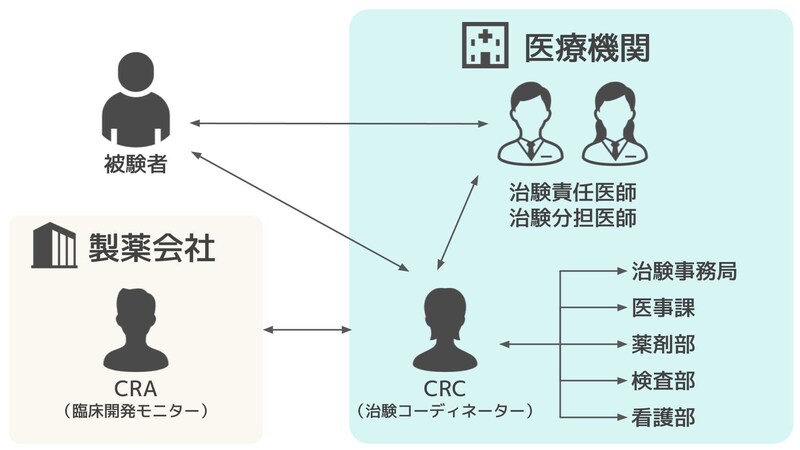
CRAと混同されやすい職種に治験コーディネーター(CRC)が挙げられます。
製薬会社側の立場から治験を管理するCRAに対して、治験コーディネーターは医療機関側の立場から医師や各部署と協力し、被験者となる患者さんをサポートします。
▼治験コーディネーター(CRC)についてはこちらの記事をチェック!
治験コーディネーター(CRC)の仕事内容、なり方、必要な資格、給料などについて!
1-2.CRAの働く場所
CRAの主な就業先は製薬会社とCRO(医薬品開発業務受託機関)の2つ。CROは製薬会社が実施する治験業務を受託・代行する企業のことです。
製薬会社で勤める場合は、基本的には自社開発の治験薬のみ取り扱います。一方、CROで働く場合はさまざまな製薬会社から治験業務を請け負うため、幅広い治験薬に携わることとなります。
2.CRAの仕事内容
CRAは治験の場で、主に症例データの収集やモニタリング、進捗状況の管理をおこないます。詳しい業務内容を、治験の流れに沿って確認してみましょう。
2-1.治験開始前
・SOP(標準業務手順書)の作成
治験にかかる業務を適切に遂行できるよう、その手順について体系的にまとめた手順書がSOPです。CRAはこのSOPを作成し、内容を遵守しながら治験を管理していかなければなりません。
また実施医療機関にも個別のSOPが存在するため、CRAはそのSOPの内容が「医薬品の臨床試験の実施の基準に関する省令(Good Clinical Practice=GCP)」を満たしているかをチェックする必要があります。
こういった手順書を作成するためには、治験における臨床現場について熟知していなければなりません。日頃からの、医師や看護師、治験コーディネーターなどとの情報交換や、さまざまな治験薬および対象の疾患についての勉強が大切です。
・医療機関、治験責任医師、医学専門家の選定と契約
治験の実施について、GCPにおいては下記の規定が存在します。
第4条の2治験の依頼をしようとする者は、医師、歯科医師、薬剤師その他の治験の依頼及び管理に係る業務を行うことにつき必要な専門的知識を有する者を確保しなければならない。
第6条
治験の依頼をしようとする者は、第35条に掲げる要件を満たしている実施医療機関及び第42条に掲げる要件を満たしている治験責任医師を選定しなければならない。
つまり、治験を成功へと導くために、CRAには治験を適正に実施できる医療機関・治験責任医師・医療専門家を選定する役割があります。各関係者および医療機関の選定後は、治験参加への依頼と契約の締結をおこないます。
・スタートアップミーティングの実施
スタートアップミーティングとは、治験実施の契約後、治験責任医師・看護師・治験薬管理者・治験コーディネーター等と治験開始前におこなう合同会議を指します。
円滑に効率よく治験を実施するには、関係各所との十分な打ち合わせと調整が必須なため、このスタートアップミーティングを万全な状態でおこなうことが非常に重要です。
2-2.治験開始
・治験薬の交付、管理
治験開始にあたり、CRAは医療機関へ治験薬を交付します。治験薬の交付は必ず治験の契約の締結後におこないます。
また、医療機関に交付された治験薬はSOP(標準業務手順書)およびGCPに従って管理・保管される必要があります。CRAは治験薬が適切に管理されているかを都度確認し、不備があれば指摘します。
例えば「室温保存」の治験薬であっても、ただ医療機関の一室に保管しておけばよいわけではなく、定義に合った温度管理が必要になります。
日本薬局方における温度に関する定義 |
|---|
標準温度:20℃ |
・同意説明文書の作成依頼および確認
被験者に対する同意説明文書の作成を治験責任医師に依頼します。CRAは、作成に必要な資料を提供するなどしてサポートしたのち、適切に同意取得されたかを確認します。
なお、CRAが被験者に直接治験の説明をしたり、同意を得たりすることはありません。治験コーディネーターや治験責任医師が仕事をしやすいように、環境を整える役割を担います。
また、CRAは被験者を集めるサポートもします。被験者の数が足りない場合には、電子カルテをスクリーニングしたり広告を利用したりして被験者への登録を促します
・モニタリング
モニタリングはCRAの基本的かつ主となる業務です。治験の品質担保や安全管理のために、GCPや治験実施計画書に従っておこなわれているかを確認します。
CRAがモニタリングしたあらゆる内容は「モニタリング報告書」として記録されます。
確認項目の例
- ・被験者ごとの適切な原資料(カルテや病院記録)や同意説明文書が用意されているか
- ・被験者が対象条件に該当しているか
- ・併用禁止の薬が使用されていないか
- ・治験薬は適切に投与されているか
- ・臨床検査値が基準を満たしているか
- ・有害事象(重篤な副作用など)が発生していないか
モニタリングと並行して症例報告書(CRF)の確認・修正もおこないます。症例報告書は、治験コーディネーターや治験責任医師が作成する資料で、治験における被験者のあらゆるデータが記載されています。
CRAは原資料と症例報告書を付き合わせ、記載漏れがないか、治験除外基準に該当していないかなどをチェックし、必要なデータや修正箇所などを治験コーディネーターや治験責任医師に説明します。
2-3.治験終了時
・治験の終了処理および手続き
SOP(標準業務手順書)に従って終了手続きをおこないます。残薬の廃棄や紛失数等の確認、必須とされる文書の確認などの対応がすべて完了し、治験の終了報告・通知を出すことで治験終了となります。


