中国の江南大学(Jiangnan University)で行われた研究によって、食用糸状菌に遺伝子編集を行うことで、従来より2.24倍の効率で糖からタンパク質を生産できる新株の開発に成功しました。
しかも、遺伝子に余分なモノを入れるのではなく、一部の「余分な仕掛け」を取り除く形で改良しており、安全性や受け入れやすさも視野に入っています。
しかもタンパク質の質そのものも向上し、菌体の硬い壁が薄くなったことで“しなやかな肉質”に近づくよう設計されているのです。
私たちは本当に「菌のお肉」を食べる日が来るのでしょうか?
研究内容の詳細は 2025年11月19日に『Trends in Biotechnology』にて発表されました。
目次
- 遺伝子編集で生まれた“菌のお肉”
- 遺伝子編集で「菌のお肉」の生産速度が88%増加
- 遺伝子編集したのに「遺伝子組み換え食品」にはならない
遺伝子編集で生まれた“菌のお肉”

「肉キノコ」と聞くと奇妙に思えるかもしれません。
しかし実際、キノコが属する真菌類が作るタンパク質は代替肉の有力候補なのです。
例えばフザリウム・ヴェネナートゥム(Fusarium venenatum)という真菌は、自然な風味や繊維質の食感が肉に近く、英国・欧州、米国や中国など世界各地で食品として利用されつつあります。
この菌由来の食品(マイコプロテイン〈真菌タンパク〉)は、牛肉など一部の畜産肉と比べて温室ガス排出量を大きく(約8〜9割)削減でき、必要な農地も9割前後少なくて済むとの報告もあります。
肉の需要拡大に伴う環境問題への対策として、「肉キノコ」は大きな期待を集めています。
コラム:肉キノコの正体とは?
記事では「肉キノコ」と書いてあるため森の奥にドンと生えている巨大なマッシュルームを想像してしまうかもしれません。確かにFusarium venenatum は、キノコと同じ真菌類ですが、実際には目に見える形でキノコのカサを作らないタイプの真菌であり、分類的にはシイタケやベニテングダケ(担子菌)よりもトリュフ(子嚢菌)に近い存在です。また胞子を作る器官が顕微鏡サイズなのも大きな違いです。
この菌が見つかったのは、20世紀後半と比較的最近のことです。イギリスの食品企業グループが「少ない資源でタンパク質を作れそうな微生物はいないか」と土壌サンプルを片っ端から調べていたとき、たまたま一つの試験管の中で、もこもことよく育つ菌が見つかりました。それが後にフザリウム・ヴェネナータムと名付けられ、今回の研究に続く原料候補として育てられていくことになります。
では、この菌はどのくらいの大きさになるのでしょうか。スタート地点は、もちろん肉眼では見えない小さな胞子です。これを糖やアンモニアなどを溶かした培地に入れ、巨大なステンレスタンクの中で温度と酸素を管理しながら育てていきます。最初のうちは、透明なスープの中を細い糸のような菌糸が泳いでいるだけですが、時間がたつとそれらがからまり合い、やがてクリーム色の綿のような“ふわふわしたかたまり”になってきます。さらに発酵が進むと、タンクの中は、細い麺を何層にも重ねたような状態になり、かき混ぜ棒に絡みつく「布」のような塊として肉眼で確認できるようになります。ここまでくると、タンクから培養液ごと取り出してフィルタープレスや遠心分離にかけることで、水を切った「菌糸のペースト」を収穫できます。見た目は、濡れたスポンジか、豆腐カス(おから)をぎゅっと固めたような質感で、ここから味付けや成形をしてナゲットやハンバーグの形にしていきます。
とはいえ、その菌のお肉にも乗り越えるべき壁がありました。
フザリウム・ヴェネナートゥムは細胞の外側を覆う細胞壁が厚く、主成分のキチン(人が消化しにくい食物繊維質)のせいで内部のタンパク質を十分には活かしきれないとされています。
また微生物とはいえ培養には相当な資源を要し、大量の糖や栄養分を加えた培地を大型タンクで発酵させる必要があります。
実際、少量のマイコプロテインを育てるだけでもかなりの糖やエネルギーが必要となり、生産コストや環境負荷の面で改良の余地があると考えられていました。
そこで研究チームは発想を転換しました。
遺伝子を直接いじって、この菌肉の「消化されやすさ」と「育ちやすさ」の両方を良くできないだろうかと考えたのです。
狙ったのはゲノム編集「CRISPR」による菌の体質改善でした。
第一著者の呉暁慧(Xiaohui Wu)氏は「多くの人がマイコプロテインは持続可能だと思っていましたが、生産プロセス全体の環境負荷を下げる方法は十分に検討されていませんでした」と述べています。
菌自体の栄養価と生産効率を遺伝子レベルで底上げできれば、代替タンパク質生産の新しいブレイクスルーになるかもしれません。
果たして、遺伝子の改良で「肉キノコ」の栄養と環境の両立は本当に可能なのでしょうか?
遺伝子編集で「菌のお肉」の生産速度が88%増加
肉キノコは実現できるのか?
研究チームは代替肉に使われる菌(フザリウム・ヴェネナータゥム)の遺伝子にハサミを入れました。
CRISPR/Cas9(クリスパー、狙ったDNAを切断するゲノム編集技術)を用いて、この菌から2つの遺伝子を同時に取り除いたのです。
1つは細胞壁を作る酵素「キチン合成酵素」の遺伝子で、これを壊すことで細胞壁を薄くしタンパク質を取り出しやすくします。
もう1つは「ピルビン酸デカルボキシラーゼ」という酵素の遺伝子で、これがあると糖からエタノールを作る際にCO₂(二酸化炭素)が発生します。そこであえてこの経路を弱め、糖から不要なCO₂へ逃げてしまう流れを断ち切り、その分をタンパク質合成に回す狙いです。
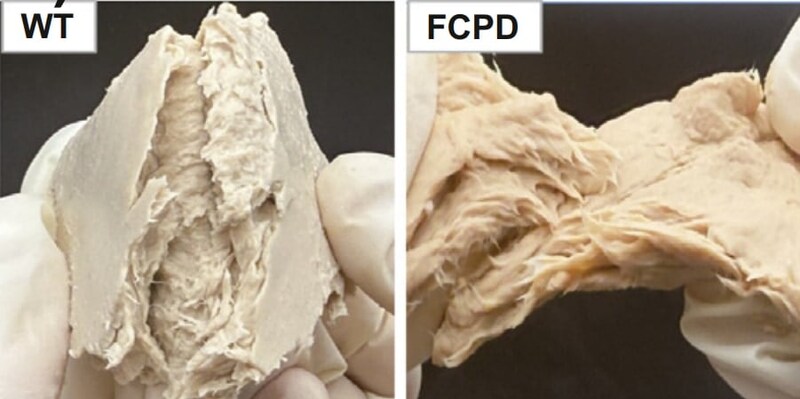
こうして2種類の遺伝子を同時に潰した新株を作製し、研究チームはこれをFCPD株と命名して培養を行いました。
結果、菌の性質は劇的に変わりました。
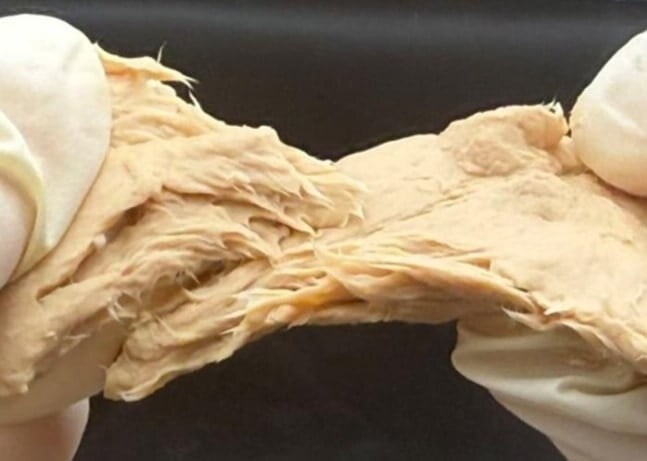
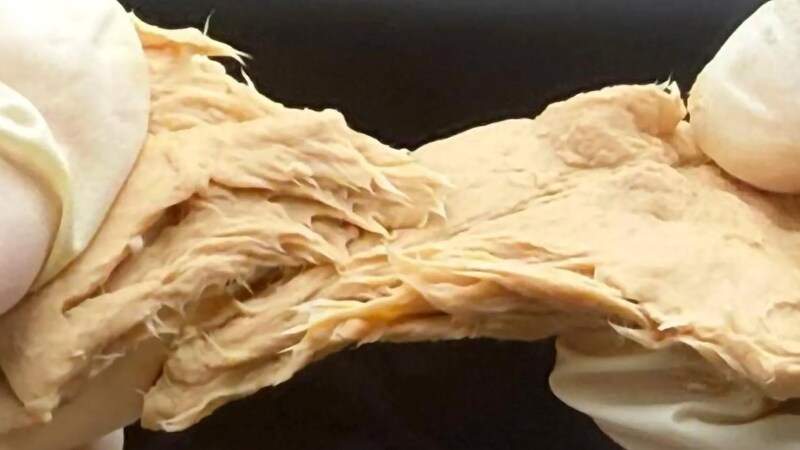
まず、遺伝子改変によってFCPD株の細胞壁は確かに薄くなり、キチン含有量は元の株(WT株)より約29%低下しました(加熱処理前の比較で)。
細胞壁が柔らかくなった分、人がその中の栄養を取り出しやすくなると理論的には考えられますが、今回の試験では全体のタンパク質消化率はWT株よりやや低くなっており、この点は今後の検証が必要です。
またタンパク質中の必須アミノ酸のバランスも改善し、栄養の質を示す指数EAAI(必須アミノ酸指数)は約32.9%向上しました。
つまり、この肉キノコは「硬い殻を破る設計をほどこし、タンパク質の質も向上した」のです。
次に、生産効率の飛躍的な向上が確認されました。
工業規模(5,000リットル発酵タンク)での培養比較では、新株FCPDは同じ重量の菌体(マイコプロテイン)を得るのに必要なブドウ糖を44.3%も削減できました。
言い換えると、砂糖1に対し作れるタンパク質の量が従来株の約2.24倍にも増えた計算です(グルコース→タンパク質への変換効率)。
さらに成長スピードも向上し、一定量のタンパク質を作る所要時間は従来株の約半分近くまで短縮されました(生産速度+88.4%)。
改良によって、菌が糖から作り出すタンパク質の量と速さが大幅にアップしたのです。
環境面での効果も見逃せません。
研究ではライフサイクルアセスメント(LCA)と呼ばれる手法で、原料調達から製造まで含めた環境フットプリントの比較評価が行われました。
その結果、新株FCPDによるマイコプロテイン生産は、従来株に比べ温室効果ガス排出量があらゆる試算シナリオで減少し、その削減率はシナリオによって4%から61.3%に及ぶことが示されました。
投入する糖を大幅に節約できたことが環境負荷低減の主因であり、実際にFCPD株で作った「肉キノコ」の環境性能は、鶏肉の生産と比べても温室ガス排出量や土地利用など多くの指標で環境負荷が低いと試算されています。
培養肉(細胞培養由来の人工肉)との比較でもFCPD株の方が持続可能性が高く、植物由来タンパク質ほどの低負荷には及ばないものの、従来の菌株より格段に環境に優しいことが確認されています。