子供の頃、水が氷になるあるいはその逆の「まさにその瞬間」を見てみたいと思ったことはないでしょうか?
冷蔵庫の中に水を満たしたコップを入れて人生最初の科学実験を行った人も多いでしょう。
しかし、水から氷、氷から水になる瞬間を直接見た人は稀でしょう。
それが分子レベルとなればなおさらです。
日本の東京理科大学(TUS)などで行われた研究によって、固体と液体の両方の性質を同時に持つような“隠れた水の状態”を観測することに成功しました。
これは、水が固体と液体の間でどのように振る舞うかを理解する上で画期的な進展であり、将来的にはエネルギー貯蔵などの新しい技術への応用にもつながる可能性があります。
一体、水はなぜこんな不思議な動きをするのでしょうか?
研究内容の詳細は2025年8月27日に『Journal of the American Chemical Society』にて発表されました。
目次
- 氷=固体”は本当に正しいのか?
- 「氷の中で動く水分子たち」不思議な状態を観測!
- 氷と液体、その狭間で見えた新しい世界
氷=固体”は本当に正しいのか?

水ほど身近でありながら、その正体が完全には解明されていない物質は他にあまりないでしょう。
私たちは水が固体(氷)・液体(水)・気体(水蒸気)の三つの姿をとることを知っていますが、水にはそれ以外にも驚かされる顔があります。
例えば、氷は0℃未満では固い固体になりますが、その表面近くでは分子の結びつき(水素結合)が氷の内部よりゆるくて、不規則な動きをする薄い(液体に近い)層が形成されることが指摘されています。
つまり氷の表面には、氷と液体のあいだのような状態が既に身近な現象として存在しているのです。
子どもの頃に抱いた「氷=いつも完全に固体」という考え方は、教育上の簡略化であって、現実の氷は必ずしもそうではありません。
また、氷の表面で見られる「水のような状態」は、氷の滑りやすさの一因とされています。
コラム:スケートで滑れるのは圧力で氷が溶けているからではない
かつてスケートなどで氷の上を滑れる理由として「スケートブーツの刃の圧力によって氷が溶ける」とする圧力融解説が知られていましたが、現在では刃の圧力だけで氷を溶かして滑れるようにするには、必要な圧力や条件が現実的ではない(選手個人の体重程度では無理)ということが指摘されています。
では、「氷でも水でもない状態」とはいったい何なのでしょうか?
近年の複数の研究でも、中間状態の正体を解き明かそうと様々なアプローチが試みられてきました。
たとえば、コップの水を冷凍庫に入れて凍らせると、水分子はかなりしっかりと固定された氷になります。
一方、常温のコップの水では分子が自由に動き回る液体です。
しかし、ごく狭い場所に閉じ込められた水ではこの単純な二択が崩れることがあります。
ナノメートルサイズという極めて小さな空間に入った水は、周囲の壁との相互作用が強く影響し、普通の水とは異なる振る舞いを示すのです。
たとえば、壁に近い水分子は壁の原子とより強く結びつき/中心付近の水分子とは異なる動きをします。
結果として、壁に近い層・中間の層・中心部の層という三つの層が形成され、水分子クラスター(WMC)の内部に“小さな階層構造”ができあがります。
しかし、このような階層構造や氷と液体が入り混じったような状態を直接観察するのは非常に困難な挑戦でした。
その理由は、X線や中性子などを使った解析では、溶けかかって動いている水分子の細かな構造や運動を捉えるのが難しいためです。
では、研究者たちはこの“隠れた水の状態”をついにとらえることに成功したのでしょうか?
「氷の中で動く水分子たち」不思議な状態を観測!
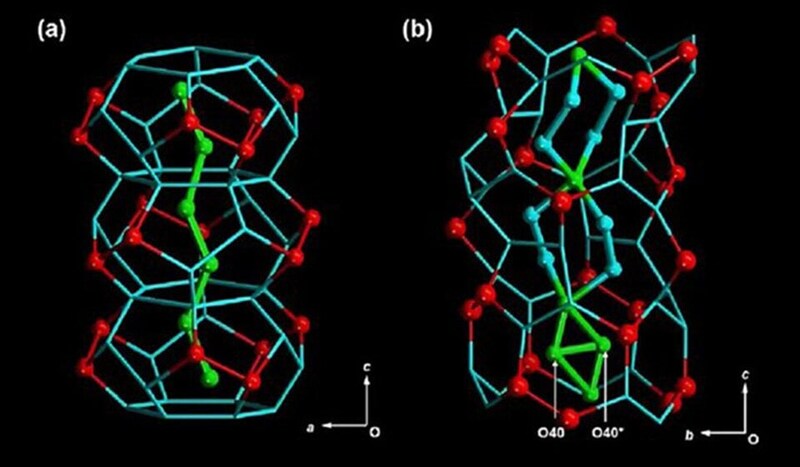
水が凍って氷になるとき、実際には水分子が一体どんな動きをしているのか――これまで詳しく見た人はいませんでした。
そこで、研究者たちは水が氷になる瞬間の「舞台」を実験室に再現し、詳しく調べることにしました。
まず彼らは、普通のコップの代わりに非常に細かい穴(ナノ細孔)が無数に開いた特別な結晶を使いました。
この細孔は直径が約1.6ナノメートル(1メートルの10億分の1)という、とても小さい穴でできています。
その中に「重水」と呼ばれる特別な水を凍らせて閉じ込めました。
重水とは、水をつくる水素原子が少し重たい「重水素」に置き換わったもので、水の動きを詳しく見るために役立ちます。
この細孔の中では、水分子が20個くらい集まって、「水分子クラスター」という小さなまとまりを作ります。
この小さな空間で水分子がどのように動くのかを見ることで、「水が氷に変わる瞬間の謎」を解き明かそうとしたのです。
では、実際の実験はどのように行ったのでしょうか?
まずは凍らせた重水のクラスターをゆっくりと温めていきました。
すると、普通ならば完全に氷として固まっているはずの重水の一部が、ある温度に達した瞬間に少しずつ動き出したのです。
その「変化」が最初に現れたのは約マイナス90℃(183 K)のときでした。
この温度あたりから、重水のクラスターは「前融解」という状態に入ります。
前融解とは、氷のように見えても内部では水分子が動き出しているという不思議な状態のことです。
さらに温度をマイナス70℃(203〜213 K)くらいまで上げると、水分子の動きが急激に活発になり、目には見えないながらも内部で大きな変化が起こり始めました。
これが「前融解状態」と呼ばれる、氷と液体の水が入り混じったような状態です。
では、前融解状態の水分子は具体的にどれくらい速く動いているのでしょう?
それを知るため、研究者たちは「固体²H NMR」という特別な測定方法を使いました。
これは重水素を含んだ水の分子がどのように動くかを、電波を使って詳しく調べる技術です。
測定の結果、前融解状態の水分子は「およそ10億分の1秒(10⁻⁹秒)」という極めて短い時間で向きを変えていることがわかりました。
これは氷の中の水分子が動くスピードよりはるかに速く、通常の液体の水に近いスピードでした。
つまり、水分子は固体の氷のようにしっかりとした結びつきを保ちながらも、液体のように非常に素早く動いているのです。
イメージで言えば、まるで水分子が氷でできた小さな檻の中で活発に踊っているかのようです。
コラム:重水とは何か?――「飲んでも大丈夫?」
重水(D₂O)は、普通の水(H₂O)と非常によく似ていますが、水素原子のうち2つが「重水素」という、通常の水素より中性子が1つ多いタイプに置き換わっている水です。重水素というのは、化学的にはほぼ同じ振る舞いをしますが、原子の質量が少し重く、それに伴ってさまざまな物理・化学的な性質が微妙に変化します。その違いには、まず“重さ(密度)”があります。重水の密度は普通の水より約 10%高く、つまり同じ体積なら重いです。また、氷になる温度(融点)が普通の水より少し高く、沸騰する温度もわずかに違います。水の分子が作る“水素結合”という仲間同士の引きつけあいも、重水素を使ったもののほうが少し強く、壊れにくくなるため、化学反応の速度や分子運動の特性が普通の水とは異なります。では、「重水を飲んでも平気か?」という疑問についてですが、科学的な実験とデータで見ると、「少量なら問題ないが、多量になると体に悪影響が出る可能性がある」というのが答えです。重水は放射性ではなく(重水素は安定同位体であるため)、放射線による影響を心配する必要は基本的にはありません。たとえば一杯程度(数 ml から数十 ml)の重水を飲むことは、普通は健康に害を及ぼさないとされています。ですが、体内の水のかなりの割合を重水で置き換える(20〜50%程度になる)と、細胞分裂や代謝(体が栄養を処理したり修復したりする働き)が妨げられることが動物実験で確かめられています。もし目の前に重水入りのボトルがあっても、常用はやめたほうがいいでしょう。
さらに興味深いことに、この不思議な状態はX線を使った分析でも確認されました。
X線分析は、物質の内部を「写真」のように静止画として映し出す方法です。
この分析でも、水分子が氷のように整然と並んでいる構造と、一方で動いている水分子が存在するということが分かりました。
つまり、NMRという方法で水分子の速い動きを捉えつつ、X線解析によってその動きがどのように配置されているかを理解できたのです。
この研究によって、これまで「固体」と「液体」の二つの状態しかないと考えられていた水の世界に、第三の「混ざった状態」が存在することが初めて詳しく描かれました。